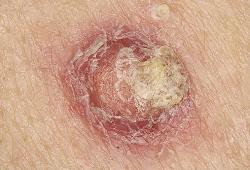
Il 5-fluorouracile topico provoca la regressione del carcinoma cutaneo a cellule squamose indotto dall'inibitore di BRAF
 La proteina chinasi BRAF regola la crescita cellulare attraverso la proteina chinasi attivata dai mitogeni (MAPK). In circa la metà dei melanomi BRAF è mutato e agisce come un oncogene conducente che stimola la proliferazione cellulare, la sopravvivenza e la progressione del tumore (Davies et al., 2002; Gray-Schopfer et al., 2007). I farmaci anti-BRAF, il vemurafenib (PLX4032/RG7204) e il dabrafenib (GSK2118436) hanno ottenuto delle risposte cliniche obiettive in circa il 60% dei pazienti affetti da melanoma i cui tumori esprimevano un mutante BRAF (Flaherty et al., 2010; Chapman et al., 2011; Sosman et al., 2012), validando questi farmaci come opzione terapeutica per i pazienti con melanoma BRAF-mutante. Un effetto collaterale inatteso di vemurafenib è che induce il cheratoacantoma (KA) e il carcinoma cutaneo a cellule squamose ben differenziato (cuSCCs) in ~26% dei pazienti (Flaherty et al., 2010; Sosman et al., 2012).
La proteina chinasi BRAF regola la crescita cellulare attraverso la proteina chinasi attivata dai mitogeni (MAPK). In circa la metà dei melanomi BRAF è mutato e agisce come un oncogene conducente che stimola la proliferazione cellulare, la sopravvivenza e la progressione del tumore (Davies et al., 2002; Gray-Schopfer et al., 2007). I farmaci anti-BRAF, il vemurafenib (PLX4032/RG7204) e il dabrafenib (GSK2118436) hanno ottenuto delle risposte cliniche obiettive in circa il 60% dei pazienti affetti da melanoma i cui tumori esprimevano un mutante BRAF (Flaherty et al., 2010; Chapman et al., 2011; Sosman et al., 2012), validando questi farmaci come opzione terapeutica per i pazienti con melanoma BRAF-mutante. Un effetto collaterale inatteso di vemurafenib è che induce il cheratoacantoma (KA) e il carcinoma cutaneo a cellule squamose ben differenziato (cuSCCs) in ~26% dei pazienti (Flaherty et al., 2010; Sosman et al., 2012).
Questo si verifica perché, anche se gli inibitori di BRAF bloccano la via di segnalazione MAPK nelle cellule che ospitano mutazioni di BRAF, essi comunque attivano la via nelle cellule esprimenti un mutante di RAS (sarcoma del ratto) o in quelle in cui RAS è attivato dal recettore tirosin-chinasico (Hatzivassiliou et al., 2010; Heidorn et al., 2010; Poulikakos et al., 2010). Criticamente, il 21-57% delle lesioni cutanee non-melanoma che si sviluppano nei pazienti trattati con vemurafenib veicolano delle mutazioni somatiche in HRAS o KRAS (Oberholzer et al., 2011; Su et al., 2012). Recentemente abbiamo usato un modello murino di carcinogenesi cutanea a due stadi per studiare come gli inibitori di BRAF guidino lo sviluppo di queste lesioni cutanee non-melanoma (Su et al., 2012).
I topi FVB/N sono stati trattati con una singola applicazione topica del cancerogeno 7,12-dimetilbenzene-(a)antracene (DMBA), che induce mutazioni HRAS Q61L nei cheratinociti. I topi sono stati quindi trattati settimanalmente con un promotore tumorale, il 12-O-tetradecanoil-forbolo-13-acetato (TPA) e giornalmente con dosi orali di PLX4270 (vedi Procedure Sperimentali Supplementari online) — un inibitore di BRAF che è preferito per gli studi sui topi a causa della sua maggiore assimilazione orale — (Su et al., 2012).
Abbiamo dimostrato che PLX4720 accelera la crescita delle lesioni squamoproliferative nei topi trattati con DMBA/TPA ma non provoca lesioni nei topi trattati con il solo DMBA (Su et al., 2012). Questi dati hanno dimostrato che il vermurafenib non è di per sé un promotore tumorale, ma piuttosto agisce accelerando la progressione delle lesioni precancerose preesistenti negli individui suscettibili. Non è noto se i cuSCCs che si sviluppano nei pazienti trattati con il vemurafenib hanno potenziale metastatico diverso dai cuSCCs che si sviluppano in assenza dell'inibizione di BRAF, perché le lesioni di entrambi vengono trattate con l'asportazione chirurgica.
Tuttavia, i pazienti con melanoma in stadio avanzato possono sviluppare lesioni multiple eruttive più precocemente durante la terapia con gli inibitori di BRAF e queste lesioni possono essere anche difficili da gestire chirurgicamente.
Abbiamo quindi cercato di sviluppare un approccio non invasivo per il trattamento di questi particolari pazienti. Gli studi precedenti hanno dimostrato che gli inibitori di BRAF accelerano la proliferazione delle cellule RAS-trasformate (Hatzivassiliou et al., 2010; Heidorn et al., 2010; Poulikakos et al., 2010; Su et al., 2012). Abbiamo confermato che le lesioni cutanee non-melanoma nei topi trattati con DMBA/TPA/PLX4720 hanno un alto indice proliferativo; inoltre, abbiamo dimostrando che essi hanno un elevato indice mitotico (5 × 10 campi ad alta potenza) e una forte positività per Ki-67 e, quindi, abbiamo voluto studiare se i farmaci antiproliferativi potessero indurne la regressione.
Storia della pubblicazione:
Titolo: Topical 5-Fluorouracil Elicits Regressions of BRAF Inhibitor–Induced Cutaneous Squamous Cell Carcinoma
Rivista: Journal of Investigative Dermatology (2013) 133, 274–276; doi:10.1038/jid.2012.268; published online 16 August 2012
Autori: Amaya Viros, Robert Hayward, Matthew Martin, Sharona Yashar, Clarissa C Yu, Berta Sanchez-Laorden, Alfonso Zambon, Dan Niculescu-Duvaz, Caroline Springer, Roger S Lo e Richard Marais
Affiliazioni:Signal Transduction Team, The Institute of Cancer Research, London, UK Seccio Dermatologia, Departament de Medicina, Hospital Universitari Vall d'Hebron, Barcelona, Spain Department of Pathology and Laboratory Medicine, David Geffen School of Medicine, University of California, Los Angeles, Los Angeles, California, USA Division of Dermatology, Department of Medicine, David Geffen School of Medicine, University of California, Los Angeles, Los Angeles, California, USA Gene and Oncogene Targeting Team, CR-UK Cancer Therapeutics Unit, The Institute of Cancer Research, Sutton, Surrey, UK Molecular Oncology Laboratory, The Paterson Institute for Cancer Research, Manchester, UK
Abstract:
The protein kinase BRAF regulates cell growth through the mitogen-activated protein kinase (MAPK) pathway. In about half of the melanomas, BRAF is mutated and acts as a driver oncogene that stimulates cell proliferation, survival, and tumor progression (Davies et al., 2002; Gray-Schopfer et al., 2007). The anti-BRAF drugs vemurafenib (PLX4032/RG7204) and dabrafenib (GSK2118436) achieve objective clinical responses in about 60% of melanoma patients whose tumors express mutant BRAF (Flaherty et al., 2010; Chapman et al., 2011; Sosman et al., 2012), validating these drugs as a therapeutic option for BRAF-mutant melanoma patients. An unexpected side effect of vemurafenib is that it induces keratoacanthomas (KA) and well-differentiated cutaneous squamous cell carcinomas (cuSCCs) in ~26% of patients (Flaherty et al., 2010; Sosman et al., 2012). This is because, although BRAF inhibitors block MAPK signaling in cells harboring BRAF mutations, they activate the pathway in cells expressing mutant RAS (Rat sarcoma) or when RAS is activated by receptor tyrosine kinases (Hatzivassiliou et al., 2010; Heidorn et al., 2010; Poulikakos et al., 2010). Critically, 21–57% of the nonmelanoma skin lesions that develop in vemurafenib-treated patients carry somatic mutations in HRAS or KRAS (Oberholzer et al., 2011; Su et al., 2012). We recently used a mouse two-stage skin carcinogenesis model to investigate how BRAF inhibitors drive the development of these nonmelanoma skin lesions (Su et al., 2012). FVB/N mice were treated with a single topical application of the carcinogen 7,12-dimethylbenz-(a)anthracene (DMBA), which induces HRAS Q61L mutations in keratinocytes. The mice were then treated weekly with the tumor promoter 12-O-tetradecanoyl-phorbol-13-acetate (TPA) and daily with oral doses of PLX4270 (see Supplementary Experimental Procedures online), a BRAF inhibitor that is preferred for mouse studies because of its superior oral bioavailability (Su et al., 2012). We demonstrated that PLX4720 accelerated the growth of squamoproliferative lesions in DMBA/TPA-treated mice but did not induce lesions in mice treated with DMBA alone (Su et al., 2012). These data demonstrated that vermurafenib is not a tumor promoter per se; rather, it acts by accelerating the progression of preexisting, premalignant lesions in susceptible individuals. It is not known whether the cuSCCs that develop in vemurafenib-treated patients have metastatic potential different from cuSCCs that develop in the absence of BRAF inhibition, because in both the clinical settings these lesions are treated by surgical excision. However, advanced-stage melanoma patients on BRAF inhibitors can develop multiple eruptive lesions early during the course of BRAF inhibitor therapy and these can be challenging to manage surgically. We therefore sought to develop a noninvasive approach to treat these particular patients. Previous studies have shown that BRAF inhibitors accelerate the proliferation of RAS-transformed cells (Hatzivassiliou et al., 2010; Heidorn et al., 2010; Poulikakos et al., 2010; Su et al., 2012). We confirmed that the nonmelanoma skin lesions in DMBA/TPA/PLX4720-treated mice have a high proliferative index by showing that they have a high mitotic index (5 × 10 high-power fields) and strong positive staining for Ki-67 (Figure 1a), and thus we investigated whether antiproliferative drugs could induce their regression.