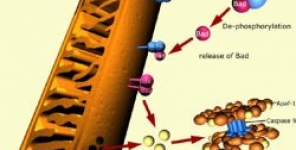
Fasi di apoptosi delle cellule di melanoma influenzano la maturazione delle cellule dendritiche mieloidi
 In questo studio abbiamo valutato se la maturazione dalle cellule dendritiche mieloidi (DCs) derivate dai monociti sia diversamente influenzata dall'assunzione di cellule morenti di melanoma umano in fasi distinte dell'apoptosi. La maturazione delle DCs derivate dai monociti, come documentato dall'analisi del fenotipo e dall'attività immunostimolante delle cellule T, è stata inibita dalla fagocitosi delle cellule morenti di melanoma contenenti una grande frazione di cellule in apoptosi precoce (Annessina-V+ e ioduro di propidio−), ma è stata promossa dagli stessi tumori in apoptosi tardiva/necrosi secondaria (annessina-V+ e ioduro di propidio−) o da cellule morenti per necrosi primaria.
In questo studio abbiamo valutato se la maturazione dalle cellule dendritiche mieloidi (DCs) derivate dai monociti sia diversamente influenzata dall'assunzione di cellule morenti di melanoma umano in fasi distinte dell'apoptosi. La maturazione delle DCs derivate dai monociti, come documentato dall'analisi del fenotipo e dall'attività immunostimolante delle cellule T, è stata inibita dalla fagocitosi delle cellule morenti di melanoma contenenti una grande frazione di cellule in apoptosi precoce (Annessina-V+ e ioduro di propidio−), ma è stata promossa dagli stessi tumori in apoptosi tardiva/necrosi secondaria (annessina-V+ e ioduro di propidio−) o da cellule morenti per necrosi primaria.
Questi effetti opposti sulla maturazione delle DC sono stati osservati dopo assunzione di cellule apoptotiche precoci o tardive per la maggior parte da tumori primari con una fase di crescita verticale e da tutte le metastasi, ma non dopo l'assunzione di cellule morenti da un tumore primario con una fase di crescita radiale o da melanociti adulti normali. L'inibizione della maturazione delle DC da parte delle cellule di melanoma in apoptosi precoce è stata correlata con l'espressione di interleuchina-10 in cellule neoplastiche ed è stata impedita dalla preincubazione delle cellule tumorali con un anticorpo neutralizzante verso l'interleuchina-10, prima dell'assunzione del tumore dalle DCs. La cross-presentazione dell'antigene gp100 associato al melanoma, verso i CTLs peptide-specifici attraverso HLA-A*0201+ delle DCs è stata raggiunta 48-72 h dopo fagocitosi di cellule di melanoma HLA-A*0201− in apoptosi o in necrosi primaria, ma solo quando il fattore di necrosi tumorale-α è stato aggiunto alle DCs 4 h dopo l'inizio della fagocitosi tumorale.
Questi risultati suggeriscono che le fasi di apoptosi e di trasformazione neoplastica influenzano la maturazione delle DCs mieloidi che assorbono le cellule morenti della linea dei melanociti. Tuttavia, le cellule neoplastiche in apoptosi tardiva o anche in necrosi primaria, inducono solo una differenziazione parziale delle DC parziale non sufficiente a raggiungere cross-presentazione degli antigeni tumorali ai CTLs a meno che un'ulteriore maturazione delle DC sia promossa da segnali aggiuntivi.
Questi risultati suggeriscono un nuovo meccanismo di fuga tumorale che può impedire lo sviluppo dell'immunità antitumorale attraverso il blocco di maturazione indotta nelle Dcs da parte delle cellule neoplastiche nella fase precoce di apoptosi.
Fonte:
Titolo: Phases of Apoptosis of Melanoma Cells, but not of Normal Melanocytes, Differently Affect Maturation of Myeloid Dendritic Cells
Rivista: Cancer Research. November 15, 2001
Autori: Gabriella Pietra, Roberta Mortarini, Giorgio Parmiani, Andrea Anichini
Affiliazioni: Units of Human Tumors Immunobiology [Ga. P., R. M., A. A.] and Human Tumors Immunotherapy [Gi. P.], Department of Experimental Oncology, Istituto Nazionale per lo Studio e la Cura dei Tumori, Via Venezian 1, 20133 Milan, Italy
Abstract:
In this study, we investigated whether maturation of monocyte-derived myeloid dendritic cells (DCs) is differentially affected by the uptake of dying human melanoma cells in distinct phases of apoptosis. Maturation of monocyte-derived DCs, as documented by phenotype analysis and T-cell immunostimulatory activity, was inhibited by phagocytosis of dying melanoma cells containing a large fraction of cells in early apoptosis (Annexin-V+ and propidium iodide−) but promoted by the same tumors when in late apoptosis/secondary necrosis (Annexin-V+ and propidium iodide+) or when dying by primary necrosis. These opposite effects on DC maturation were observed after the uptake of early or late apoptotic cells from most vertical growth phase primary tumors and all metastases but not after the uptake of dying cells from a radial growth phase primary tumor or normal adult melanocytes. Inhibition of DC maturation by early apoptotic melanoma cells correlated with expression of interleukin-10 in neoplastic cells and was prevented by preincubating the tumor cells with a neutralizing antibody to interleukin-10 before tumor uptake by DCs. Cross-presentation of the melanoma-associated antigen gp100209–217 to peptide-specific CTLs by HLA-A*0201+ DCs was achieved 48–72 h after phagocytosis of HLA-A*0201− melanoma cells in apoptosis, or primary necrosis, but only when tumor necrosis factor-α was added to DCs 4 h after the initiation of tumor phagocytosis. These results suggest that phases of apoptosis and neoplastic transformation affect maturation of myeloid DCs that take up dying cells of the melanocyte lineage. However, neoplastic cells in late apoptosis, or even in primary necrosis, induce only a partial DC differentiation not sufficient to achieve cross-presentation of tumor antigens to CTLs unless further DC maturation is promoted by additional signals. These results suggest a novel mechanism of tumor escape that may prevent the development of antitumor immunity through the maturation block induced in DCs by neoplastic cells in the early phase of apoptosis.