Il genotipo del recettore per la melanocortina-1 codificato in linea germinale è associato con la gravità del fenotipo cutaneo di nevi melanocitici
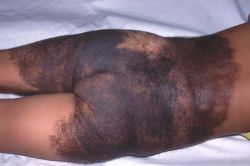 I nevi melanocitici congeniti (CMN) sono voglie pigmentate che coinvolgono fino all'80% della superficie cutanea. L'aumento della frequenza di CMN nelle famiglie di persone severamente colpite è indicativo di un genotipo predisponente in linea germinale.
I nevi melanocitici congeniti (CMN) sono voglie pigmentate che coinvolgono fino all'80% della superficie cutanea. L'aumento della frequenza di CMN nelle famiglie di persone severamente colpite è indicativo di un genotipo predisponente in linea germinale.
Abbiamo notato un'alta prevalenza di capelli rossi nelle famiglie colpite, e abbiamo considerato il ruolo di MC1R in questa condizione. Una coorte di 166 soggetti con CMN sono stati sottoposti a fenotipizzazione della regione pigmentata, con genotipizzazione di MC1R per 113 individui. I risultati sono stati confrontati con un gruppo di controllo locale di 60 bambini non imparentati con individui CMN e con 300 bambini inglesi senza CMN.
I soggetti con CMN hanno avuto una più alta prevalenza di capelli rossi e di genitori con capelli rossi rispetto ai controlli locali ed hanno avuto un più alto tasso di eterozigosi e omozigosi composta per le varianti di MC1R. La presenza dell'allele V92M o R (D84E, R151C, R160W, D294H) è stata associata con un aumento delle dimensioni di CMN, ipotizzando per questi alleli un effetto nella promozione della crescita. Inaspettatamente, gli alleli V92M e R151C sono stati anche fortemente associati con il peso alla nascita nella coorte di individui CMN, un risultato confermato nel gruppo di controllo. L'effetto del genotipo germinale di MC1R sullo sviluppo e sulla gravità della CMN ci ha portato a studiare i più ampi effetti potenziali sulla crescita, rivelando un ruolo di MC1R nel normale sviluppo fetale.
Storia della pubblicazione:
Titolo: Germline Melanocortin-1-Receptor Genotype Is Associated with Severity of Cutaneous Phenotype in Congenital Melanocytic Nevi: A Role for MC1R in Human Fetal Development
Rivista: Journal of Investigative Dermatology (2012) 132, 2026–2032; doi:10.1038/jid.2012.95; published online 10 May 2012
Autori: Veronica A Kinsler, Sayeda Abu-Amero, Peter Budd, Ian J Jackson, Susan M Ring, Kate Northstone, David J Atherton, Neil W Bulstrode, Philip Stanier, Raoul C Hennekam, Neil J Sebire, Gudrun E Moore e Eugene Healy
Affiliazioni: Department of Paediatric Dermatology, Great Ormond Street Hospital for Children, London, UK
Clinical and Medical Genetics Unit, Institute of Child Health, London, UK
MRC Human Genetics Unit, Western General Hospital, Edinburgh, UK
School of Social and Community Medicine, University of Bristol, Bristol, UK
Department of Plastic Surgery, Great Ormond Street Hospital for Children, London, UK
Neural Development Unit, Institute of Child Health, London, UK
Department of Paediatrics, Academic Medical Centre, University of Amsterdam, Amsterdam, The Netherlands
Department of Histopathology, Great Ormond Street Hospital for Children, London, UK
Dermatopharmacology, University of Southampton, School of Medicine, Southampton, UK
Abstract:
Congenital melanocytic nevi (CMN) are pigmented birthmarks that affect up to 80% of the skin surface area. The increased frequency of CMN in families of severely affected individuals is suggestive of a predisposing germline genotype. We noted a high prevalence of red hair in affected families, and considered a role for MC1R in this condition. A cohort of 166 CMN subjects underwent pigmentary phenotyping, with MC1R genotyping in 113. Results were compared with a local control group of 60 unrelated children and with 300 UK children without CMN. CMN subjects had higher prevalences of red hair and a red-haired parent than local controls and had a higher rate of compound heterozygosity and homozygosity for MC1R variants. The presence of a V92M or R allele (D84E, R151C, R160W, D294H) was associated with increasing size of the CMN, implying a growth-promoting effect of these alleles. Unexpectedly, the V92M and R151C alleles were also strongly associated with birth weight in the CMN cohort, a finding confirmed in the control group. The effect of germline MC1R genotype on development and severity of CMN led us to investigate potential broader effects on growth, revealing a role for MC1R in normal fetal development.





