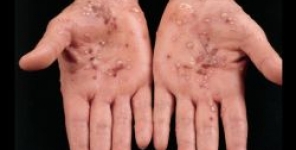
Nei casi di psoriasi da moderata a grave, secukinumab batte ustekinumab
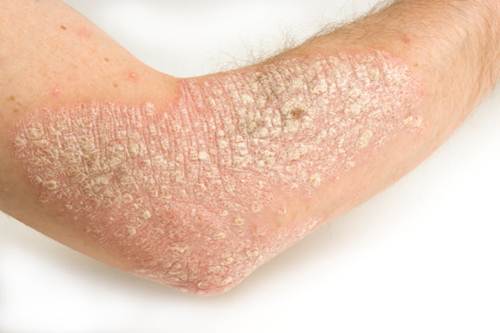
Nel corso di un nuovo studio sperimentale finanziato da Novartis, i pazienti affetti da psoriasi hanno sperimentato un maggior miglioramento della qualità della vita relativa alle condizioni di salute (HRQoL) durante la terapia con secukinumab rispetto alla terapia con ustekinumab.
"Lo studio CLEAR dimostra che secukinumab è superiore a ustekinumab nei soggetti con psoriasi a placche da moderata a grave, con un livello di sicurezza del tutto comparabile", scrivono il Dr. Diamant Thaci, della clinica universitaria dello Schleswig-Holstein in Germania, e colleghi nell'edizione online del Journal of the American Academy of Dermatology.
Il team ha arruolato 676 partecipanti adulti con psoriasi a placche da moderata a grave (distribuiti in 134 luoghi diversi in tutto il mondo) in uno studio randomizzato, in doppio cieco della durata di 52 settimane. I pazienti hanno ricevuto iniezioni sottocutanee di secukinumab 300 mg o ustekinumab 45 mg (per i pazienti con peso fino a 100 kg) o 90 mg (per i pazienti di peso superiore a 100 kg).
La somministraszione di secukinumab (Cosyntex, Novartis) è stata effettuata al baseline e alle settimane 1, 2, e 3, successivamente ogni 4 settimane per un periodo lungo fino a 48 settimane. L'ustekinumab (Stelara, Janssen) è stato somministrato al baseline e alla settimana 4, poi ogni 12 settimane dalla settimana 16 alla 40.
Alla conclusione dello studio i ricercatori hanno esaminato i risultati alla settimana 16 e hanno rilevato che il 79,0% dei pazienti in terapia con secukinumab ha soddisfatto i criteri per l'endpoint primario, indicato come un miglioramento di almeno il 90% nel punteggio del Psoriasis Area and Severity Index (PASI). Per i pazienti in terapia con ustekinumab la percentuale di soggetti che hanno soddisfatto i criteri dell'endpoint primario è stata del 57.6% (P < 0.0001).
I pazienti che hanno avuto un miglioramento nel punteggio PASI del 100% alla 16esima settimana sono stati il 44,3% per il gruppo secukinumab e il 28,4% per il gruppo ustekinumab (P < 0.0001).
Per quanto riguarda il criterio della qualità della vita relativamente alle condizioni di salute (HRQoL), nel gruppo secukinumab il 71,9% dei partecipanti non ha riportato alcun peggioramento secondo l'indice dermatologico di qualità della vita (Dermatology Life Quality Index, DLQ), rispetto al 57,4% dei soggetti nel gruppo ustekinumab (P < 0.0001).
Il 64,2% dei pazienti nel gruppo secukinumab ha riportato almeno un evento avverso, rispetto al 58,3% dei pazienti nel gruppo ustekinumab. I ricercatori hanno scritto che "i problemi sono stati da lievi a moderati, facilmente gestibili e non hanno portato alla sospensione del farmaco". Alla settimana 16 non ci sono state morti.
"Ciò che questo studio mostra è che in un campione ampio, il secukinumab è stato più efficace di ustekinumab nell'aiutare la pelle dei pazienti a riacquistare uno stato sano o pressoché sano (definito secondo l'indice PASI, 90-100). Il secukinumab aveva già dimostrato in precedenza di essere superiore all'etanercept", ha dichiarato la Dr.ssa Abby Van Voorhees della University of Pennsylvania Perelman Center for Advanced Medicine.
"Tuttavia, ciò che lo studio non dice è se il singolo paziente avrà questo tipo eccezionale di risposta terapeutica. "In genere i pazienti rispondono ai farmaci in maniera diversa da individuo ad individuo", ha continuato la Dr.ssa Van Voorhees, che non ha preso parte allo studio:
"Quindi, tutto sommato, la dimostrazione di questo alto grado di risposta alla terapia con secukinumab è un'ottima notizia". "Non mi ha sorpreso vedere questo tipo di risposta alla terapia, data la nostra sempre maggiore comprensione della patogenesi della psoriasi che ci ha consentito di agire farmacologicamente sul sistema immunitario con un'efficacia mai vista prima. Credo che, data la nostra attuale comprensione dell'impatto della psoriasi sulla qualità della vita dei pazienti, il nuovo standard terapeutico dovrebbe essere quello di riportare, a seguito del trattamento utilizzato, l'aspetto della pelle del paziente ad uno stato normale o quasi".
Janssen Pharmaceuticals, in una dichiarazione rilasciata a seguito della pubblicazione dello studio, ha fatto sapere che: "sono stati generati più di cinque anni di dati per Stelara durante i trial clinici e durante lo studio PSOLAR, dati che dimostrano la sua significativa e consistente risposta clinica e il mantenimento dei risulati ottenuti dopo un anno di trattamento, nonché il profilo positivo dal punto di vista rischio/beneficio". Data la sua efficacia a lungo termine, la sua sicurezza e la possibilità di creare profili di dosaggio personalizzati, crediamo nella competitività di Stelara rispetto ad altri tipi di terapia".
Riferimenti:
Journal of the American Academy of Dermatology, online edition, 17 June 2015