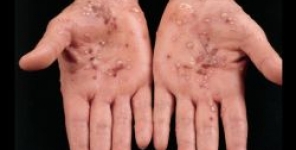
Anormali residui di isoaspartile nelle membrane degli eritrociti di pazienti affetti da psoriasi
 La deamidazione proteica spontanea delle asparagine (Asn) labili, che genera residui anormali di isoaspartile (IsoAsp), è associata con l'invecchiamento delle cellule ed è potenziata da un microambiente ossidativo.
La deamidazione proteica spontanea delle asparagine (Asn) labili, che genera residui anormali di isoaspartile (IsoAsp), è associata con l'invecchiamento delle cellule ed è potenziata da un microambiente ossidativo.
La presenza di legami isopeptide altera la struttura/funzione della proteina e può scatenare reazioni autoimmuni. Per minimizzare il danno, l'IsoAsp può essere "riparato" da una specifica proteina L-isoaspartato-(D-aspartato) O-metiltransferasi. La condizione di stress ossidativo cronico in pazienti psoriasici, e il potenziale ruolo eziologico di antigeni-self sconosciuti, ci ha spinto ad indagare riguardo la deaminazione Asn nei tessuti psoriagici.
Gli eritrociti (RBC) sono stati selezionati come il sistema modello poiché, mancando l'apparato di sintesi proteica, essi non sono in grado di sostituire le proteine danneggiate. Sono stati ottenuti campioni di sangue da 36 pazienti e da 34 controlli. l-isoAsp contenuto era fortemente aumentato nelle proteine di membrana degli RBC da pazienti psoriasici. Le specie deaminate hanno incluso anchirina, banda 4.1, banda 4.2 e la proteina integrale di membrana banda 3. Un'analisi funzionale ha dimostrato che questo risultato non è correlato ad una ridotta efficienza del sistema di riparazione dipendente della S-adenosilmetionina suggerendo una maggiore instabilità proteica nei siti Asn, responsabile dell'accumulo di IsoAsp in pazienti psoriasici.
Fonte:
Titolo: Abnormal isoaspartyl residues in erythrocyte membranes from psoriatic patients
Rivista: Archives of Dermatological Research. doi: 10.1007/s00403-012-1247-z
Autori: Stefania D'Angelo, Serena Lembo, Filomena Flora, Maria Luigia De Bonis, Anna Balato, Fabio Ayala, Nicola Balato, Patrizia Galletti, Vincenzo Zappia
Affiliazioni: Faculty of Motor Sciences, DiSIST, Parthenope University, via Medina 40, Naples, Italy
Department of Biochemistry and Biophysics "F. Cedrangolo", Second University of Naples, Via De Crecchio n.7, 80138 Naples, Italy
Department of Dermatology, University of Naples "Federico II", Via Pansini n. 5, 80131 Naples, Italy
Abstract:
Spontaneous protein deamidation of labile asparagines (Asn), generating abnormal isoaspartyl residues (IsoAsp), is associated with cell aging and enhanced by an oxidative microenvironment. The presence of isopeptide bonds impairs protein structure/function and can trigger autoimmune responses. To minimize the damage, IsoAsp can be "repaired" by a specific l-isoaspartate-(d-aspartate)-protein-O-methyltransferase. The condition of chronic oxidative stress reported in psoriatic patients, and the potential etiological role of unknown self-antigens, prompted us to investigate Asn deamidation in psoriatic tissues. Erythrocytes (RBC) were selected as the model system since, lacking protein synthesis apparatus, they are unable to replace damaged proteins. Blood samples were obtained from 36 patients and 34 controls. l-isoAsp content was highly increased in RBC membrane proteins from psoriatic patients. Deamidated species included ankyrin, band 4.1, band 4.2 and the integral membrane protein band 3. A functional analysis demonstrated that this result was unrelated to a reduced efficiency of the S-adenosylmethionine-dependent repair system suggesting an increased protein instability at Asn sites, responsible for IsoAsp accumulation in psoriatic patients.
https://www.youtube.com/@djfdm