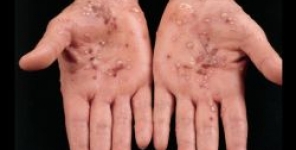
Nuovo farmaco per la psoriasi di Xenoport supera la fase II
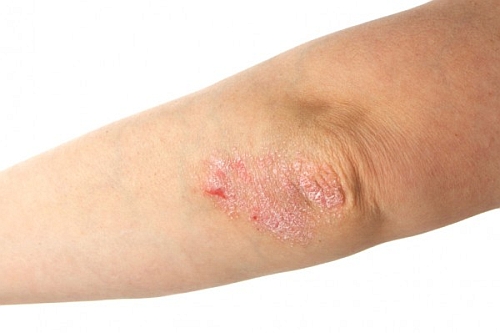
L'azienda farmaceutica Xenoport Inc. ha annunciato che il suo farmaco in via di sperimentazione per il trattamento della psoriasi ha superato la seconda fase di test clinici.
La compagnia ha fatto sapere che il farmaco, da assumere per via orale, si è mostrato efficace nel trattamento della psoriasi a placche da moderata a severa, durante i testi di fase II.
Xenoport ha dichiarato di voler dare il via alla fase finale dei testi clinici entro il prossimo anno e di star considerando la possibilità di una partnership per velocizzare lo sviluppo del farmaco.
Secondo il National Institute of Health, negli Stati Uniti la psoriasi interessa il 2,0-2,6% della popolazione, con un tasso di incidenza più alto nella popolazione di origine caucasica; inoltre, circa il 15% dei pazienti affetti da psoriasi finisci per sviluppare anche l'artrite psoriasica.
Il farmaco, conosciuto per il momento come XP23829, ha "raggiunto gli obiettivi prefissati sia al dosaggio di 800 mg una volta al giorno che al dosaggio di 400 mg due volte al giorno, mostrato un miglioramento statisticamente significativo rispetto al baseline già alla dodicesima settimana di utilizzo (miglioramento valutato rispetto allo Psoriasis Area and Severity Index, PASI)" e, stando a quanto dichiarato dall'azienda farmaceutica in un comunicato stampa, "XP23829 si è dimostrato sicuro ed è generalmente ben tollerato dai pazienti".
"XP23829 è un prodotto a base di monometilfumarato (MMF), la sua formulazione è stata specificamente progettata per poter offrire a medici e pazienti un'opzione terapeutica che fosse altrettanto efficace e al tempo stesso meglio tollerata dei farmaci a base di acido fumarico attualmente presenti sul mercato".
Nell'ambito dei farmaci per la cura della psoriasi, l'agenzia americana FDA ha approvato all'inizio dell'anno Cosentyx (secukinumab) di Novartis, mentre Eli Lilly & Co ha avviato la sperimentazione su Ixekizumab.
Infine, la canadese Valeant Pharmaceuticals International Inc ha comprato i diritti per il farmaco sperimentale Brodalumab di AstraZeneca, che aveva raggiunto la fase finale di sperimentazione prima che questa venisse sospesa da Amgen nel maggio dello scorso anno.