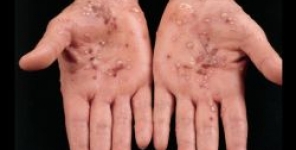
CHMP: sì a ixekizumab per la psoriasi a placche

Il Comitato europeo per i prodotti medicinali per uso umano (Committee for Medicinal Products for Human Use, CHMP) ha espresso parere positivo sull'approvazione alla messa in commercio di ixekizumab (Taltz, Eli Lilly) per il trattamento di pazienti adulti con psoriasi a placche da moderata a severa.
Ixekizumab è un anticorpo monoclonale che ha come obiettivo l'interleuchina-17A (IL-17), responsabile del processo infiammatorio nella psoriasi.
Il parere del CHMP si basa sui dati provenienti da tre studi multicentrici di fase III, condotti in doppio cieco, che hanno dimostrato l'efficacia e la sicurezza di ixekizumab in oltre 3.800 pazienti con psoriasi a placche da moderata a severa.
Tutti e tre gli studi hanno valutato contro placebo l'efficacia e la sicurezza di ixekizumab (80 mg ogni due settimane, dopo una dose iniziale da 160 mg) dopo 12 settimane di terapia. Due degli studi comprendevano anche una comparazione con etanercept (50 mg due volte a settimana).
L'agenzia europea per il farmaco ha sottolineato che ixekizumab ha mostrato "effetti clinicamente rilevanti e statisticamente significativi" contro placebo e contro etanercept rispetto allo Psoriasis Area and Severity Index.
Le più comuni reazioni avverse al farmaco nei test sono state lievi o moderate infezioni del tratto respiratorio superiore. Il CHMP ha raccomandato la prescrizione di ixekizumab solo da parte di medici esperti nel trattamento e nella diagnosi della psoriasi.
Raccomandazioni più dettagliate sull'utilizzo di ixekizumab saranno descritte nel riassunto delle caratteristiche del prodotto, che sarà pubblicato nella relazione di valutazione e reso disponibile in tutte le lingue ufficiali dell'Unione europea, dopo l'autorizzazione all'immissione in commercio da parte della Commissione Europea.
Eli Lilly ha dichiarato di aspettarsi una decisione definitiva in merito all'immissione in commercio entro i prossimi 3 mesi.
Ixekizumab sarà disponibile come soluzione per iniezione con dosaggio da 80 mg.