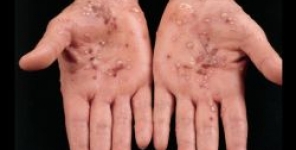
CHMP raccomanda brodalumab per la psoriasi a placche

Il comitato per i medicinali a uso umano (CHMP) dell'agenzia europea per il farmaco (EMA) ha raccomandato l'autorizzazione alla commercializzazione di brodalumab per il trattamento della psoriasi a placche, nei pazienti adulti idonei alla terapia sistemica.
Brodalumab è un inibitore di interleuchina che sarà disponibile sotto forma di soluzione iniettabile da 210 mg. Brodalumab è un anticorpo monoclonale che si lega con IL-17RA e inibisce l'attività biologica delle citochine infiammatorie IL-17A, IL-17F, IL-17A/F het. e IL-25.
Brodalumab inibisce l'infiammazione e i sintomi clinici associati alla psoriasi. Gli effetti collaterali più frequenti sono artralgia, emicrania, stanchezza, diarrea e dolore orofaringeo.
L'agenzia americana per il farmaco (FDA) ha approvato brodalumab (Siliq, Valeant Pharmaceuticals) per indicazioni simili nel febbraio del 2017, ma ha imposto un avvertimento circa il rischio di ideazioni e azioni suicide a seguito dell'assunzione del farmaco. Negli Stati Uniti, brodalumab è disponibile soltanto tramite un programma di valutazione e mitigazione dei rischi, che regola l'accesso al farmaco.
Brodalumab dovrebbe essere usato soltanto sotto la supervisione di un medico con esperienza nella diagnosi e nella terapia della psoriasi. Dopo la concessione dell'autorizzazione all'immissione in commercio,ulteriori raccomandazioni circa l'uso di brodalumab saranno rese disponibili insieme a un rapporto sulle caratteristiche del prodotto, pubblicato in tutte le lingue ufficiali dell'unione.